PCR, qPCR, RT-PCR
PCR (polymerase chain reaction - polymerázová řetězová reakce) a její další modifikace jsou amplifikační metody, jež mají za cíl zmnožit určitý segment nukleové kyseliny. Smysl diagnostické metody vychází z toho, že tento jeden úsek nukleové kyseliny je charakteristický pouze pro jeden druh mikroorganismu. Průkazem přítomnosti daného segmentu nukleové kyseliny ve vzorku tedy zárověň prokazujeme přítomnost daného mikroorganismu. PCR nemá využití pouze v mikrobiologii, ale setkáváme se s ním v široké škále vědních oborů. V mikrobiologii má nezastoupitenou funkci např. u antigenně podobných virů, které nelze diagnostikovat imunologickými metodami (riziko falešně pozitivního výsledku).
Princip PCR spočívá v cyklickém množení určitého úseku DNA pomocí DNA polymerázy. Amplifikovaná DNA se poté vizualizuje dalšími metodami. Teoreticky stačí, aby byla ve vzorku přítomna jen jedna molekula DNA. Celá reakce se provádí v mikrozkumavkách v zařízení zvaném termocykler, které umí v krátkém časovém intervalu měnit teploty až o několik desítek stupňů.
Pro samotnou reakci je nutno dodat do mikrozkumavky několik ingrediencí. Základem je templátová DNA ze vzorku, dále pak dva primery, které ohraničí úsek, který chceme amplifikovat, a DNA polymeráza. Používá se tzv. Taq polymeráza (z bakterie Thermus aquaticus) pro její výraznou termostabilitu. Celá reakce se realizuje ve vhodném pufru a nesmí samozřejmě chybět nadbytek nukleotidů, aby bylo možné z něčeho DNA syntetizovat.
Celá reakce se sestává ze tří kroků:
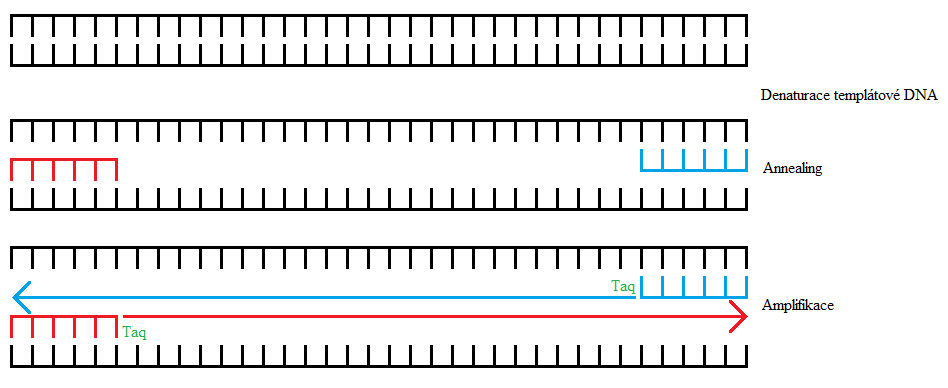
1. Denaturace DNA
První krok probíhá při vysoké teplotě 95°C. Při této teplotě se rozpadnou vodíkové můstky mezi jednotlivými bázemi DNA a dvoušroubovice se tak rozvolní na dvě vlákna.
2. Annealing (dosedání primerů)
Další fáze probíhá po prudkém zchlazení směsi až na 50 - 60°C. Zchlazení způsobí regeneraci vodíkových můstků a tedy obnovu původní dvoušroubovice DNA. Ve směsi jsou však přítomny dva primery (oligonukleotidy komplementární k určité části DNA), které nasednou na obě vlákna DNA rychleji, než celá molekula stačí obnovit svůj původní tvar. Primery svým nasednutím na DNA ohraničily úsek DNA, jenž bude dále amplifikován. Zároveň jsou primery nezbytné pro syntézu DNA, jelikož Taq polymeráza není schopna syntetizovat nukleovou kyselinu od nuly, nýbrž k tomu potřebuje alespoň krátky úsek, od kterého může začít.
3. Amplifikace
Konečná fáze začíná zahříním na 65 - 75°C. Taq polymeráza začíná od primerů snytetizovat vlákno DNA, které je komplementární k templátové DNA.
Celá reakce se opakuje 30 - 40 x tak, aby došlo k zisku dostatečného počtu amplifikovaných úseků. Závislost počtu amplifikovaných úseků DNA na čase je exponenciální, neboť v následujícím kroku se k aplifikaci používají i úseky, jež byly vytvořeny v předchozích cyklech. Výsledný teoretický výtěžek reakce lze tedy spočítat dle rovnice: x = 2n, kde x je počet amplifikovaných úseků a n je počet cyklů.
Amplifikovaná DNA je poté rozdělena elektroforézou v agarózovém gelu a vizualizována vhodným barvivem (ethidium bromid, midori green).
PRC v reálném čase (real time-PCR, kvantitativní PCR - qPCR)
Vzhledem k tomu, že PCR je metoda kvalitativní, není není možné touto metodou zjistit půdodní počet molekul DNA ve vzorku. Tento problém je řešen modifikací PCR, a sice kvantitativní PCR. Touto metodou lze sledovat nárust molekul DNA v reálném čase. Výsledkem reakce je tzv. amplifikační křivka, která je porovnána s kalibračními křivkami. Porovnáním lze získat původní počet molekul DNA ve vzorku.
Real time-PCR probíhá velmi podobně jako klasická PCR. Do reakční směsi je však navíc přidána tzv. hydrolyzační sonda. Jedná se o oligonukleotid komplementární k části DNA. Tato sonda je na jednom konci (5´ konec) označena fluorescenčním barvivem a na druhém (3´ konec) tzv. zhášečem. Během annealignu nasedají na molekulu DNA primery a hydrolyzační sonda. Celá směs je osvicována světlem vhodné vlnové délky, což vede ke fluorescenci molekuly fluorescenčního barviva. Tato fluorescence se však nikterak neprojevuje, pokud je v těsné blízkosti barviva zhášeč, který toto emitované světlo pohltí. V průběhu amplifikace však narazí Taq polymeráza na hydrolyzační sondu a rozbije ji. Tímto se uvolní do roztoku fluorescenční barvivo i zhášeč, a tak se obě molekuly dostanou z těsného kontaktu, což vede k fluorescenci barviva. Množství emitovaného světla je přímo úměrné počtu amplifikovaných úseků DNA a jsme schopni jej měřit. QPCR se musí z výše popsaných důvodů provádět ve specializovaném termocykleru, který je vybaven možností osvěcovat směs v mikrozkumavkých světlem o vhodné vlnové délce, je schopen měřit množství emitovaného světla a tyto údaje poté převádět do amplifikační křivky. Na druhou stranu již odpadá elektroforéza vozorků.
RT-PCR - reverse transcriptase PCR
Zkratkou RT-PCR se někdy myslí real time-PCR, tedy výše popsaná metoda. Přesnější je pro ni však použití zkratky qPCR a zkratku RT-PCR ponechat metodě PCR s reverzní transkriptázou.
RT-PCR je metoda přizpůsobená k amplifikaci RNA. PCR z principu umí množit pouze DNA, a proto nelze použít při přímé diagnostice např. RNA virů. Aby bylo možné amplifikovat RNA, je nejprve nutné za použití enzymu reverzní transkriptázy převést RNA na DNA, a tu následně podrobit PCR. Převedenou DNA lze samozřejmě podrobit i qPCR, v takovém případě je vhodné tuto skutečnost uvést i do názvu metody, tedy qRT-PCR.