Vazba antigen-protilátka
Vazba antigen-protilátka se týká více imunologie než mikrobiologie, nicméně, vzhledem k tomu, že je základem imunologických testů, je tato znalost nezbytná i v mikrobiologii.
Antigenem rozumíme částici, která není tělu vlastní, a tedy proti ní tvoří protilátky. Na příslušný antigen se poté váže specifická protilátka. Vazba protilátky na antigen má významnou úlohu v imunitní odpovědi organismu, kdy tato vazba aktivuje nebo zprostředkovává další imunitní mechanismy (aktivace komplementu, degranulace mastocytů, indukce zánětlivé reakce, zvýšení opsonizace...). Antigenem může být jakákoliv solubilní i nesolubilní molekula, zejména proteiny, glykoproteiny, polysacharidy.
Protilátka (imunoglobulin) je protein, který se specificky váže na antigen. Protilátky jsou tvořeny plazmatickými buňkami (=diferencované B-lymfocyty). Imunoglobuliny rozdělujeme do pěti tříd (IgA, IgD, IgE, IgG, IgM), a to podle stavby konstantních domén těžkých řetězců (obr. níže). Imunoglobuliny se mohou vyskytovat jako monomery, dimery (IgA) a pentamery (IgM). Podle počtu jednotek ve struktuře imunoglobulinu se také liší počet vazebných míst.
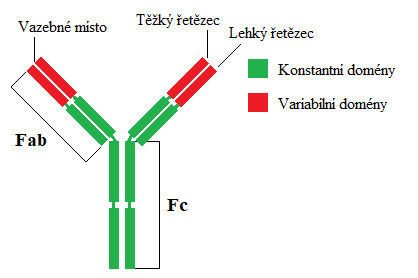
Na obrázku vidíme schématicky znázorněný imunoglobulin třídy G. Ostatní imunoglobuliny se stavbou příliš neliší. IgG se sestává ze dvou řetězců - lehký a těžký, oba vzájemně spojené disulfidovými můstky. Těžký řetězec obsahuje tři konstantní a jednu variabilní doménu, lehký řetězec po jedné doméně od každého typu. Celkové uspořádání obou řtězců tvoří písmeno Y. Celá struktura je rozdělena do dvou částí: Fc-fragmentu, který se váže na receptory bílých krvinek a Fab-fragmentu, který slouží k vazbě na antigen. Vazba imunoglobulinu na antigen je zajištěna vazebným místem, které je tvořeno variabilními doménami obou řetězců. IgG má vazebná místa tedy dvě.
Protilátky se nacházejí v krevním séru, na sliznicích (IgA), v kolostru... Ve většině případů se testuje přítomnost a koncentrace specifických protilátek v krevním séru.